পদার্থের বন্ধন
Bonding of matter
আমাদের চারপাশে আমরা যা কিছু দেখি না কেন সবই মৌলিক বা যৌগিক পদার্থ। সকল পদার্থে থাকে অসংখ্য অণু।
আবার অণু গঠিত হয় এক বা একাধিক পরমাণু দিয়ে এই আকর্ষণ শক্তি যা দ্বারা দুটি একই বা ভিন্ন মৌলের পরমাণু পরস্পর যুক্ত হয়ে অণু গঠন করে তাকে পারমাণবিক বন্ধন বলে। সকল পদার্থের অণু গঠিত হয় পারমাণবিক বন্ধনের মাধ্যমে। যেমন অক্সিজেনের দুটি পরমাণুর রাসায়নিক বন্ধন দিয়ে আবদ্ধ হয়ে অক্সিজেন মৌলের একটি মৌল গঠন করে।
এই মৌলগুলি একত্রিত হয়ে পানি গঠিত হয়। কিন্তু প্রশ্ন হলো, কেন দুটি পরমাণুর মধ্যে বন্ধন গঠিত হয়? কারণ মৌল যখন পারমাণবিক অবস্থায় থাকে তখন তা অস্থিতিশীল অবস্থায় থাকে। ফলে তার জন্য বিপুল স্থিতিশক্তি প্রয়োজন।
কিন্তু বন্ধন দ্বারা গঠিত অণুতে পরমাণু স্থিতিশীল অবস্থায় থাকে। আর স্থিতিশীল অবস্থায় স্থিতিশক্তি থাকে খুবই কম। সুতরাং পরমাণুসমূহের মধ্যে তখনই বন্ধন গঠিত হয়, যখন পরমাণুসমূহের সংযোগের ফলে সিস্টেমের স্থিতিশক্তি হ্রাস পায়।
কোনো কোনো ক্রিস্টালের যোজনী ইলেকট্রনগুলো এক পরমাণু থেকে অন্য পরমাণুতে স্থানান্তরিত হয়ে বন্ধন (bond) গঠন করে।
ক্রিস্টালের মধ্যকার ইলেকট্রনিক মিথস্ক্রিইয়া বা বন্ধনগুলো নানা ধরনের হয়ে থাকে।
পদার্থের গঠনের প্রকৃতি ও মিথস্ক্রিয়া অনুসারে পদার্থের রাসায়নিক বন্ধন প্রধানত ৫ প্রকার।
যথা-
(১) আয়নিক বন্ধন (Electrovalent bond or Ionic bond)
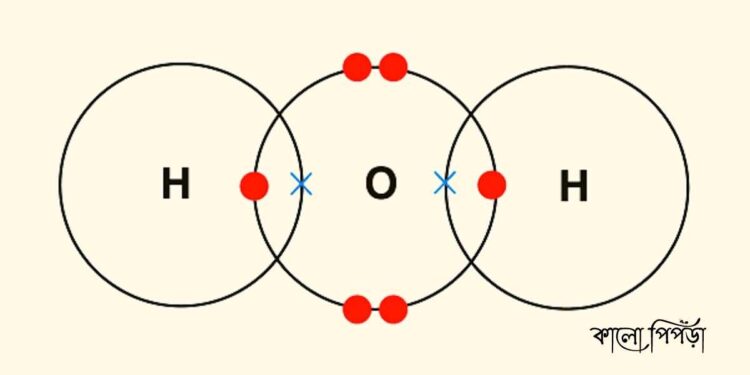
(২) সমযোজী বন্ধন (Covalent bond)
(৩) হাইড্রোজেন বন্ধন (Hydrogen bond)
(৪) ধাতব বন্ধন (Metallic bond)
(৫) ভ্যান ডার ওয়াল বলজনিত বন্ধন (Bonds due to Van Dar Waals forces)
আয়নিক বন্ধন
Ionic bond
ধাতব ও অধাতব মৌলের রাসায়নিক বিক্রিয়াকালে ধাতুর পরমাণুর বহিঃস্তর থেকে অধাতু পরমাণুর বহিস্তরে এক বা একাধিক ইলেকট্রন স্থানান্তরিত হওয়ার মাধ্যমে সৃষ্ট ধনাত্মক আয়ন এবং ঋণাত্মক আয়নের মধ্যে স্থির বৈদ্যুতিক আকর্ষণ দ্বারা যে বন্ধন গঠিত হয় তাকে আয়নিক বন্ধন বলে।