অক্সিজেন কি? অক্সিজেন এর বৈশিষ্ট্য এবং ব্যবহার
অক্সিজেন কি?
অক্সিজেন পৃথিবীতে প্রাপ্ত সবচেয়ে সাধারণ রাসায়নিক উপাদান । এটি বায়ু তৈরির অন্যতম প্রধান উপাদান এবং এটি সমস্ত গাছপালা এবং প্রাণীর বেঁচে থাকার জন্য প্রয়োজনীয়। বিজ্ঞানীরা রাসায়নিক উপাদানগুলি আবিষ্কারের পর বিভিন্ন প্রতীক দিয়ে প্রকাশ করেন। তেমনি অক্সিজেনের প্রতীক হ’ল O.
বায়ুমণ্ডলের প্রায় এক পঞ্চমাংশ হল অক্সিজেন। পানির নয় দশমাংশে (ওজন অনুসারে) অক্সিজেন থাকে। এটি প্রকৃতিতে সরাসরি পাওয়া যায় না। বিজ্ঞানীরা বায়ুতে থাকা অন্যান্য গ্যাস থেকে Oxygen আলাদা করে থাকেন।
অক্সিজেন এর বৈশিষ্ট্য
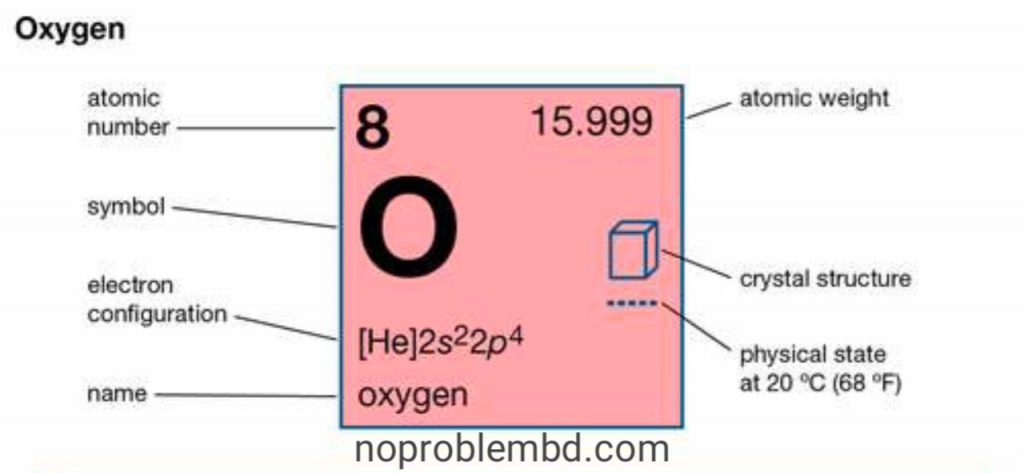
| পারমাণবিক সংখ্যা | 8 |
|---|---|
| পারমাণবিক ভর | 15.9994 |
| গলনাঙ্ক | 8218.4 ° C (61361.1 ° F) |
| স্ফুটনাঙ্ক | −183.0 ° C (7297.4 ° F) |
| ঘনত্ব (1 atm, 0 ডিগ্রি সেন্টিগ্রেড) | 1.429 গ্রাম / লিটার |
| জারণ অবস্থা | −1, −2, +2 |
| ইলেকট্রন কনফিগারেশন | 1s22s22p4 |
মুক্ত অবস্থায় অক্সিজেনের রঙ, গন্ধ বা স্বাদ কিছুই নেই। এটি -297° F (-183° C) এর নীচে তাপমাত্রায় ফ্যাকাশে নীল তরলে পরিণত হয় এবং প্রায় -360° F (-218° C) এ কঠিন হয়ে যায়। Oxygen অন্যান্য অনেক উপাদানের সাথে মিশে সহজেই যৌগিক পদার্থ তৈরি করে। সর্বাধিক প্রচলিত যৌগ হ’ল পানি (H20), যা দুটি হাইড্রোজেন পরমাণু এবং একটি অক্সিজেন পরমাণু নিয়ে গঠিত।
অক্সিজেনের একটি ফর্ম বা রূপ হ’ল ওজন (O3) যা দেখতে ফ্যাকাশে নীল গ্যাস। এটি বিস্ফোরক এবং বিষাক্ত। এটি উপরের বায়ুমণ্ডলে পাওয়া যায়। পৃথিবীর বায়ুমন্ডল রক্ষার জন্য এটি সহায়ক ভূমিকা পালন করে। এটি সূর্য থেকে ক্ষতিকারক রশ্মিকে পৃথিবী পৃষ্ঠে আসতে বাধা দেয়।
অক্সিজেন এর ব্যবহার
বেচে থাকার জন্য প্রতিটি প্রাণীর অক্সিজেন দরকার। শ্বাস নেওয়ার সময় বাতাসের Oxygen শরীরে কার্বন এবং হাইড্রোজেন উপাদান এর সাথে মিলিত হয়। যা প্রাণীর শরীরে শক্তি যোগাতে সাহায্য করে।
এরপর নিশ্বাসের সাথে কার্বন এবং Oxygen নামক একটি যৌগিক পদার্থ বের হয়ে যায় যাকে আমরা কার্বন ডাই অক্সাইড বলে থাকি। অন্যদিকে গাছপালা সালোকসংশ্লেষণ নামক একটি প্রক্রিয়ার অংশ হিসাবে সেই কার্বন ডাই অক্সাইড গ্রহণ করে । সালোকসংশ্লেষণের সময় উদ্ভিদ সমূহ কার্বন ডাই অক্সাইডকে ভেঙে পূনরায় কার্বন এবং অক্সিজেন এ পরিণত করে ফেলে। এরপর তারা কার্বন ব্যবহার করে এবং বায়ুতে Oxygen ছেড়ে দেয়।
এছাড়াও রোগীদের শরীরে অক্সিজেনের অভাব হলে চিকিৎসকরা তাদের কে বিশুদ্ধ অক্সিজেন সরবরাহ করে থাকেন। তাছাড়া তরল Oxygen রকেট ইঞ্জিনগুলি জ্বালানীতে ব্যবহৃত হয়।
- অক্সিজেনের ব্যবহার নিম্নরূপ–
- ১. অক্সি হাইড্রোজেন শিখা বিভিন্ন ধাতু গলাতে ব্যবহৃত হয়।
- ২. অক্সি এসিটিলিন শেখার উষ্ণতা 3000 ডিগ্রী সেন্টিগ্রেড। এই শিখাকে ঝালাইয়ের কাজে ব্যবহার করা হয়।
- ৩. সালফিউরিক এসিড ও নাইট্রিক এসিডের শিল্প উৎপাদন O2 ব্যবহার করা হয়।
- ৪. প্রাণিজগতের অস্তিত্বের মূলে আছে অক্সিজেন। O2 গ্যাস শ্বাসকার্যে সাহায্য করে।
- ৫. জলের নিচে ডুবুরিদের জন্য, উড়োজাহাজের চালক ও যাত্রীদের জন্য এবং মরণাপন্ন রোগীর শ্বাসকষ্ট সময় কৃত্রিম উপায়ে O2 গ্যাস সরবরাহ করা হয়।
- ৬. আগুন ছাড়া আমাদের দৈনন্দিন জীবন চলতে পারে না। অক্সিজেন আগুন জ্বালাতে সাহায্য করে।
অক্সিজেনের ধর্ম
অক্সিজেন একটি গ্যাস। এর ধর্মকে আমরা প্রাথমিকভাবে দুটি ভাগে ভাগ করতে পারি।
১. ভৌত ধর্ম এবং ২. রাসায়নিক ধর্ম
১. অক্সিজেনের ভৌত ধর্ম
- ক) অক্সিজেন বর্ণহীন, স্বাদহীন এবং গন্ধহীন গ্যাস।
- খ) এই গ্যাস বাতাসের চেয়ে সামান্য ভারী।
- গ) জলে সামান্য দ্রবীভূত হয়।
- ঘ) শ্বাসকার্যে সাহায্য করে।
২. রাসায়নিক ধর্ম
- ক) অক্সিজেন দহনে সাহায্য করে, কিন্তু নিজে দাহ্য নয়। কোন পদার্থ যখন জ্বলে তখন পদার্থটির সঙ্গে অক্সিজেনের রাসায়নিক সংযোগ ঘটে, যার ফলে অগ্নিশিখার সৃষ্টি হয়। এই জাতীয় রাসায়নিক বিক্রিয়াকে দহন বলে।
- খ) অক্সিজেনের রূপভেদ:
তিনটি অক্সিজেন পরমাণু যুক্ত হয়ে একটি ওজোন গ্যাসের অনু উৎপন্ন করে। ওজন হলো অক্সিজেনের একটি রূপভেদ। 2O3 = 3O2 - গ) রাসায়নিক স্বক্রিয়তা:
O2 অত্যন্ত সক্রিয় মৌল। সোনা, প্লাটিনাম প্রভৃতি কয়েকটি মৌল ছাড়া বেশিরভাগ ধাতু এবং অধাতু সঙ্গে প্রত্যক্ষ বা পরোক্ষভাবে যুক্ত হয়ে অক্সাইড যৌগ উৎপন্ন করে। - ঘ) অধাতুর সঙ্গে বিক্রিয়া-আম্লিক অক্সাইড গঠন:
অধাতুর সঙ্গে O2 যুক্ত হয় আম্লিক অক্সাইড উৎপন্ন করে। - একটুকরো লোহিত তপ্ত কার্বন নিয়ে একটি অক্সিজেন পুর্ন গ্যাসজারে প্রবেশ করালে কার্বন টুকরোটি আরও উজ্জ্বল ভাবে জ্বলবে এবং পুড়ে কার্বন ডাই অক্সাইড উৎপন্ন হবে। C + O2 = CO2
- প্রজ্বলন চামচে একটুকরো সালফার জ্বালিয়ে অক্সিজেনপূর্ণ গ্যাসজারে প্রবেশ করালে সালফার নীল শিখা সৃষ্টি করে জ্বলবে। সালফার অক্সিজেনের সঙ্গে যুক্ত হয়ে সালফার ডাই অক্সাইড গ্যাস উৎপন্ন করে।
- এক টুকরো ফসফরাসের আগুন ধরিয়ে একটি অক্সিজেনপূর্ণ গ্যাসজারের মধ্যে প্রবেশ করালে ফসফরাস তীব্রভাবে জ্বলতে থাকে এবং অক্সিজেনের সঙ্গে যুক্ত হয়ে ফসফরাস পেন্টা অক্সাইড উৎপন্ন করে।
- এইভাবে যে কার্বন ডাই অক্সাইড উৎপন্ন হলো তার সঙ্গে জল মেশালে দেখা যাবে কার্বনিক এসিড উৎপন্ন হয় যা নীল লিটমাসকে লাল করে দেয়। অনুরূপে সালফার ডাই অক্সাইড জলের সঙ্গে মিশে সালফিউরাস এসিড উৎপন্ন করে। ফসফরাস পেন্টা অক্সাইড জলের সঙ্গে যুক্ত হয়ে ফসফরিক এসিড উৎপন্ন করে।
- ঙ) ধাতুর সঙ্গে বিক্রিয়া ক্ষারীয় অক্সাইড গঠন:
- ধাতুর সঙ্গে অক্সিজেন যুক্ত হয়ে ক্ষারীয় অক্সাইড উৎপন্ন করে যা জলে দ্রবীভূত হলে হার উৎপন্ন করে।
- একটি ম্যাগনেসিয়াম ফিতা জ্বালিয়ে অক্সিজেনপুর্ন গ্যাসজারের মধ্যে প্রবেশ করানো হলো। ফিতাটি তীব্রভাবে জ্বলবে এবং ম্যাগনেসিয়াম অক্সাইডের সাদা চূর্ণ উৎপন্ন করবে। এটি একটি ক্ষারীয় অক্সাইড। 2Mg + O2 = 2MgO
- প্রজ্বলন চামচে এক টুকরো সোডিয়াম নিয়ে বার্নারে দিয়ে উত্তপ্ত করে অক্সিজেন পূর্ণ গ্যাসজারের মধ্যে প্রবেশ করালে সোনালি শিখাসহ জ্বলবে এবং সোডিয়াম মোনোঅক্সাইড উৎপন্ন করবে। উৎপন্ন সোডিয়াম মোনোঅক্সাইড এর মধ্যে জল দিলে সোডিয়াম হাইড্রোক্সাইড ক্ষার উৎপন্ন হবে, যা লাল লিটমাসকে নীল করে দেয়। সুতরাং O2কে ক্ষার উৎপাদক ও বলা যায়।
- লোহিত তপ্ত লোহা অক্সিজেনের সঙ্গে বিক্রিয়া করে ফেরোসোফেরিক অক্সাইড উৎপন্ন করে।
- চ) হাইড্রোজেনের সঙ্গে:
- অক্সিজেন এবং হাইড্রোজেন গ্যাসের মিশ্রণ এর মধ্যে আগুন দিলে বিস্ফোরণ ঘটে জলীয়বাষ্প উৎপন্ন হয়। জল হল একটি প্রশম অক্সাইড। 2H2 + O2 = 2H2O
- ছ) নাইট্রোজেনের সঙ্গে:
- 3000 ডিগ্রী সেন্টিগ্রেড উষ্ণতায় বিদ্যুত স্ফুলিঙ্গের সাহায্যে অক্সিজেন এবং নাইট্রোজেন যুক্ত হয়ে নাইট্রিক অক্সাইড উৎপন্ন হয়। নাইট্রিক অক্সাইড একটি প্রশম অক্সাইড। N2 + O2 = 2NO
- জ) অক্সিজেন একটি উত্তম জারক:
- বিভিন্ন পদার্থকে O2 জারিত করতে পারে। বিভিন্ন ধাতু এবং অধাতু অক্সিজেনের ( O2 ) মধ্যে উত্তপ্ত করলে জারিত হয়ে অক্সাইডে পরিণত হয়। 2Cu +O2 = 2CuO
- এই বিক্রিয়ায় সেই অক্সিজেন এর দ্বারা তাড়িত হয়ে সেই হতে পরিণত হয়েছে।
- লঘু H2SO4 যুক্ত হালকা সবুজ বর্ণের ফেরাস সালফেট দ্রবণে অক্সিজেন গ্যাস চালনা করলে ফেরাস সালফেট অক্সিজেন দ্বারা জারিত হয়ে বাদামী বর্ণের ফেরিক সালফেট উৎপন্ন করে।
- ঝ) O2 গ্যাস ক্ষারীয় পাইরোগ্যালেট দ্রবণ দ্বারা শোষিত হয়।
O2 গ্যাসের সনাক্তকরণ বা কিভাবে অক্সিজেনকে সনাক্ত করতে হয়
- ১. শিখাহীন জ্বলন্ত একটি পাটকাঠিকে অক্সিজেন পূর্ণ জারে প্রবেশ করালে কাঠিটি তীব্রভাবে জ্বলে ওঠে।
- ২. বর্ণহীন নাইট্রিক অক্সাইড গ্যাস অক্সিজেনের সংস্পর্শে আসলে বাদামী রঙের নাইট্রোজেন ডাই অক্সাইড উৎপন্ন করে। 2NO+O2=2NO2 ( বাদামি)
- ৩. ক্ষারীয় পটাশিয়াম পাইরোগ্যালেট দ্রবণে O2 শোষিত হয় এবং দ্রবণের বর্ণ বাদামি হয়।
পরীক্ষাগারে অক্সিজেন প্রস্তুতি
- ক) পরীক্ষাগারে O2 গ্যাস প্রস্তুত করার জন্য প্রয়োজনীয় রাসায়নিক দ্রব্য
১. পটাশিয়াম ক্লোরেট (KClO3)
২. ম্যাঙ্গানিজ ডাই অক্সাইড (MnO2) - খ) পরীক্ষাগারে অক্সিজেন প্রস্তুত করার নীতি
পটাশিয়াম ক্লোরেটকে খুব উত্তপ্ত করলে 610 ডিগ্রি সেন্টিগ্রেড উষ্ণতায় বিশ্লিষ্ট হয়ে পটাশিয়াম ক্লোরাইড এবং অক্সিজেন গ্যাস উৎপন্ন হয়।
পটাশিয়াম ক্লোরেট এর সঙ্গে ম্যাঙ্গানিজ ডাই অক্সাইড মেশালে কম উষ্ণতায় (200 ডিগ্রি সেন্টিগ্রেড থেকে 240 ডিগ্রি সেন্টিগ্রেড) সহজে এবং তাড়াতাড়ি অক্সিজেন গ্যাস নির্গত হয়।
2KClO3 + [MnO2] = 2KCl + 3O2 + [MnO2]
এই বিক্রিয়ায় ম্যাঙ্গানিজ ডাই অক্সাইডের নিজের কোন রাসায়নিক পরিবর্তন হয়না।বিক্রিয়ার সময় ম্যাঙ্গানিজ ডাই অক্সাইড উপস্থিত থেকে বিক্রিয়াটিকে দ্রুত করতে সাহায্য করে মাত্র। এই বিক্রিয়ায় ম্যাঙ্গানিজ ডাই অক্সাইড অনুঘটক বা ক্যাটালিস্ট রূপে ব্যবহৃত হয়।
গ) অক্সিজেন তৈরির পদ্ধতি - চার ভাগ ওজনের পটাশিয়াম ক্লোরেট এর সঙ্গে একভাগ ওজনের ম্যাঙ্গানিজ ডাই অক্সাইড ভালো করে মিশিয়ে মিশ্রণটিকে শক্ত কাঁচের টেস্ট টিউবের মধ্যে অর্ধেক ভর্তি করা হল।
- টেস্ট টিউবের মুখটি একটি সছিদ্র কর্ক দিয়ে বন্ধ করে ওই ছিদ্রের মধ্যে দিয়ে একটি নির্গম নল লাগানো হলো। নির্গম নলের শেষ প্রান্তটি একটি গ্যাস দ্রনীর মধ্যে ডোবানো থাকে।
- টেস্ট টিউবটিকে একটি ক্লাম্পের সাহায্যে স্ট্যান্ড এর সঙ্গে এমন ভাবে আটকানো হল যেন টেস্টটিউবের সামনের দিকটা একটু ঢালু থাকে।
- এখন টেষ্ট টিউব থেকে একটি বুনসেন বার্নার দিয়ে ধীরে ধীরে সমভাবে উত্তপ্ত করা হলো। কিছুক্ষণ পর নির্গমনলের শেষপ্রান্তে গ্যাস নির্গত হতে দেখা যাবে। কিছুটা গ্যাস বের হয়ে যেতে দেওয়া হল।কারণ টেস্টটিউবের ফাঁকা অংশে যে বায়ু ছিল তাকে এইভাবে বের করে দিতে হবে।
- এইবার একটি জলপূর্ণ গ্যাস জারকে গ্যাস দ্রোনীর মধ্যে ডোবানো একটি মধুকোষপিঠের উপর উপুড় করে বসানো হলো এবং নির্গম নলের শেষপ্রান্তটি কে মধকোষপিঠের ভেতর প্রবেশ করানো হলো।
- ঘ) পরীক্ষাগারে অক্সিজেন সংগ্রহ
টেস্টটিউবে উৎপন্ন O2 গ্যাস নির্গমনলের ভেতর দিয়ে এসে বুদবুদের আকারে গ্যাসজারে জলের নিম্ন অপসারণ দ্বারা জমা হতে থাকে। গ্যাস জারের জল সম্পূর্ণ অপসারিত হলে একটি কাচের চাকতি দিয়ে গ্যাস জারের মুখটি বন্ধ করে গ্যাসদ্রোনী থেকে উঠিয়ে নেওয়া হলো। এইভাবে O2 গ্যাস সংগ্রহ করা হলো।
জায়মান অক্সিজেন বলতে বিক্রিয়ায় তৈরি হওয়া সদ্যজাত O2 কে বঝায়। বিক্রিয়ায় উতপন্ন হওয়ার পরপরই এরা সমযোজী হয়ে উঠতে পারে না তাই স্বল্পস্থায়ী হয় এবং এটি তীব্র জারন ক্ষমতা ধারন করে। এই জায়মান অক্সিজেন রঙিন বস্তুকে বর্ণহীন করে দেয়। যেমন দাগযুক্ত কাপড়ে ব্লিচিং পাউডার দিয়ে কাপড় দাগমুক্ত করা হয়। ব্লিচিং + কার্বন ডাই অক্সাইড + জল বিক্রিয়া করে হাইপক্লরাস অ্যাসিড উতপন্ন করে। এই হাইপক্লরাস অ্যাসিড বিয়োজিত হয়ে জায়মান অক্সিজেন উতপন্ন করে।
শেষ কথা:
আশা করি আপনাদের এই আর্টিকেলটি পছন্দ হয়েছে। আমি সর্বদা চেষ্টা করি যেন আপনারা সঠিক তথ্যটি খুজে পান। যদি আপনাদের এই “অক্সিজেন কি? অক্সিজেন এর বৈশিষ্ট্য এবং ব্যবহার” আর্টিকেল পছন্দ হয়ে থাকে, তাহলে অবশ্যই ৫ স্টার রেটিং দিবেন।